Tous droits réservés © NeurOreille (loi sur la propriété intellectuelle 85-660 du 3 juillet 1985). Ce produit ne peut être copié ou utilisé dans un but lucratif.
A ce jour, les travaux de recherche montrent que les cellules ciliées de la cochlée des Mammifères ne peuvent se régénérer. Cependant, chez les Vertébrés inférieurs (Poissons, Batraciens et Reptiles) il y a un renouvellement permanent des cellules ciliées en condition normale et une régénération après lésion. Dans la cochlée des Oiseaux, il n'y a plus de renouvellement spontané, mais les cellules ciliées ont la capacité de régénérer après avoir été détruites (traumatisme sonore, ototoxicité), la fonction auditive étant ainsi restaurée. La compréhension des mécanismes moléculaires de cette régénération chez les Oiseaux, permettra peut-être un jour de stimuler une telle régénération dans la cochlée des Mammifères ?
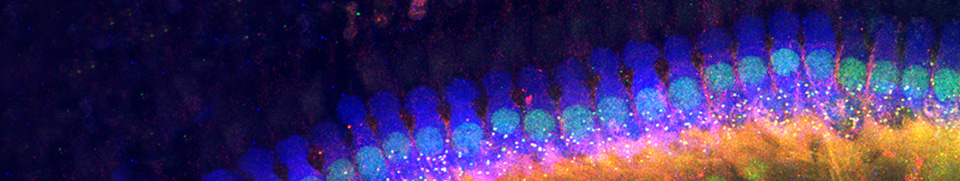
Régénération dans la cochlée (papille basilaire) d'Oiseaux
Un traumatisme sonore ou une drogue ototoxique peuvent faire disparaître les cellules ciliées de la cochlée (papille basilaire) des Oiseaux, laissant en place les seules cellules de soutien. Peu de temps après, on observe une régénération des cellules ciliées qui redonnent à ces animaux des capacités auditives assez semblables à celles qu'ils avaient temporairement perdues.
Division cellulaire versus transdifférenciation
La régénération des cellules ciliées de la cochlée avienne est basée sur deux mécanismes principaux :
1) la division cellulaire d'une cellule de soutien (SC) : une cellule fille va se différencier en cellule ciliée (HC), l'autre en nouvelle cellule de soutien ;
2) la transdifférenciation d'une cellule de soutien (SC) qui se transforme directement en cellule ciliée (HC).
J. Stone
De la cellule de soutien (SC) à la cellule ciliée (HC)
Dans le processus de régénération de la cochlée avienne, quand les HCs disparaissent les SCs reçoivent des signaux qui les incitent à enclancher le processus de régénération et impliquent plusieurs modifications de la synthèse protéique, mimant ce qui se passe au cours du développement. Ces signaux interviennent dans un délai de quelques heures après la disparition des HCs et permettent une restauration à peu près complète (en nombre de HCs) en 4 semaines.
Mécanismes moléculaires de la régénération des cellules ciliées (HCs) : possible implication d'Atoh1
Différentes protéines présentes dans les SCs promeuvent ou réduisent leur capacité à se différencier en HCs. Au cours du développement embryonnaire, Atoh1 (atonal homolog 1) un facteur de transcription helix-loop-helix est crucial pour la différenciation des cellules ciliées dans la cochlée des mammifères ; il est donc un candidat de premier choix pour stimuler la régénération. Alors qu'Atoh1 incite une SC à se différencier en HC, une autre proteine de la voie Notch agit en sens inverse en bloquant cette régénération (inhibition latérale). C'est un mécanismes qui, au cours du développement, permet la production correcte, en nombre et position, des cellules ciliées. Les récepteurs de Notch sont exprimés à la surface des SCs, alors que les proteines qui s'y lient (comme Delta) sont exprimées à la surface des HCs. Lors de la liaison récepteur-ligand le domaine intracellulaire de Notch (NICD), clivé par une gamma sécrétase, se détache et pénètre dans le noyau. Cette translocation aboutit au blocage de l'expression d'Atoh1, ce qui empêche la SC de se transformer en HC. Des résultats vraiment positifs ont, à ce jour, été obtenus sur des cochlées aviennes : ils sont résumés dans l'animation ci-dessous.
S. Blatrix, d'après B. Lewis
Dans cette animation schématique on voit 3 SCs (rose) et 2 HCs (bleu). Quand les HCs disparaissent, elles sont remplacées par les SCs et Delta est uprégulé dans certaines SCs, ce qui provoque une inhibition d'Atoh1 dans les SCs environnantes qui expriment alors Notch. La liaison Delta/Notch provoque le clivage du récepteur par une gamma secretase : son domaine interne (NICD) quite la membrane externe pour le noyau où il stimule un facteur de transcription bloquant Atoh1 expression dans ces cellules (inhibition latérale). La proteine Atoh1 s'accumule ainsi dans les SCs voisines qui vont se différencier en cellules ciliées.
NB. C'est un mécanisme de transdifférenciation de ce type qui explique une bonne partie de la régénération des cellules ciliées chez les Vertébrés inférieurs et les Oiseaux. Chez les Mammifères, Atoh1 ne joue pas un rôle aussi prédominant, car différents autres protéines qui restent à identifier doivent aussi intervenir ...
Régénération chez les Mammifères
L'espoir d'arriver à des thérapies régénératives sur la cochlée des Mammifères avait surgi dès les années 80, au moment de la découverte de la régénération sur la cochlée avienne. A ce jour, on en est encore loin et ce, malgré toutes les découvertes sur les processus moléculaires du développement, malgré les avancées considérables sur les mécanismes impliqués chez les Oiseaux (cf. ci-dessus) ...
La recherche continue dans deux directions :
1) "réveiller" des cellules "dormantes" (cellules souches)
2) greffer des cellules souches embryonnaires.
S. Blatrix, d'après J. Stone
Ceci dit, promouvoir la différenciation de nouvelles cellules ciliées est une étape, mais il faudra ensuite aider ces nouvelles cellules à se connecter correctement avec le cerveau !
Le challenge est immense et on ne peut pas, à ce stade, dire si une méthode aboutira, ni surtout à quelle date on pourra parler de thérapie basée sur la régénération !
Restauration de l'épithélium vestibulaire et de l'équilibre
Chez les non-mammaliens, quand les cellules ciliées de l'épithélium vestibulaire sont détruites, elles régénèrent spontanément entrainant la restauration de la fonction. Chez les Mamifères, plusieurs études récentes ont montré que cette régénération était aussi possible, mais qu'elle était loin d'être complète ; seule une population réduite de HCs est remplacée et la fonction n'est pas restaurée. Toutefois, ce résultat partiel est encourageant : le mécanisme est là semble-t-il, il suffirait de le "booster" ... après en avoir démonté les mécanismes intimes !
 Français
Français
 English
English
 Español
Español
 Português
Português


Facebook Twitter Google+